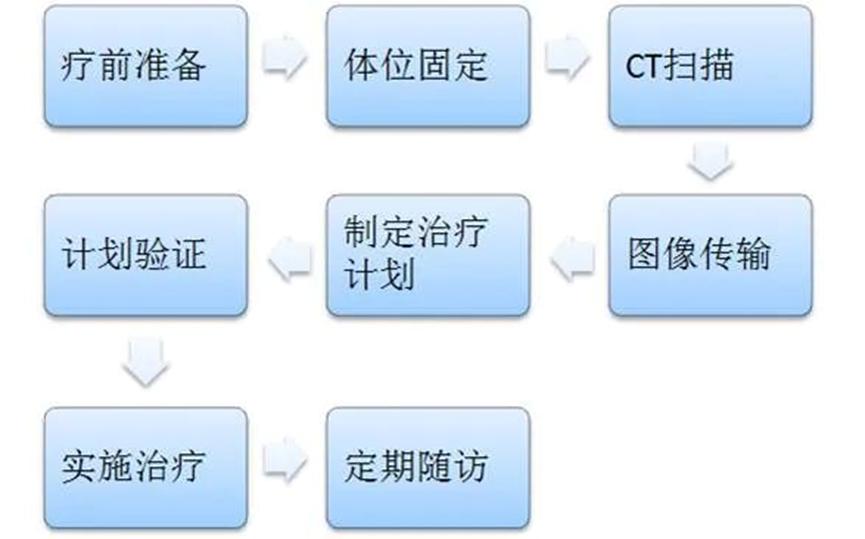
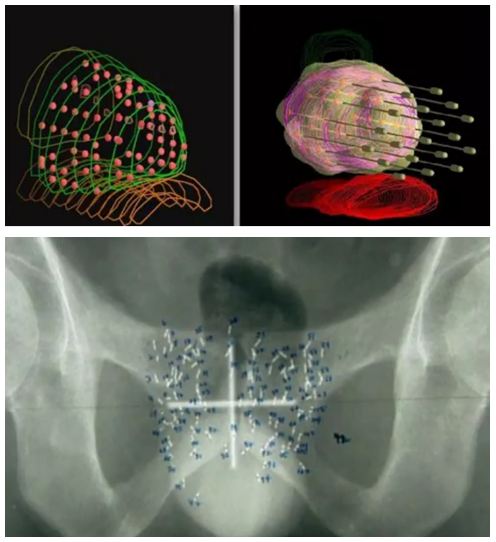
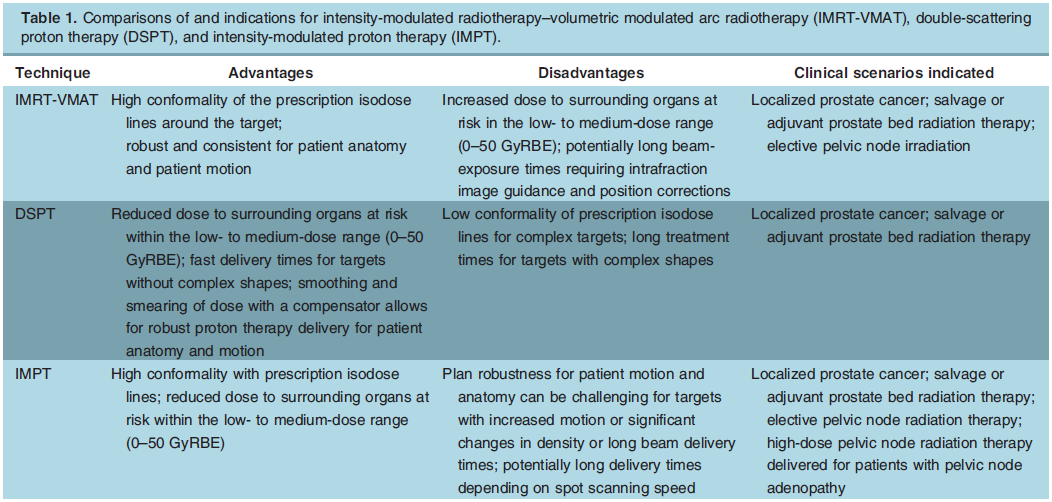
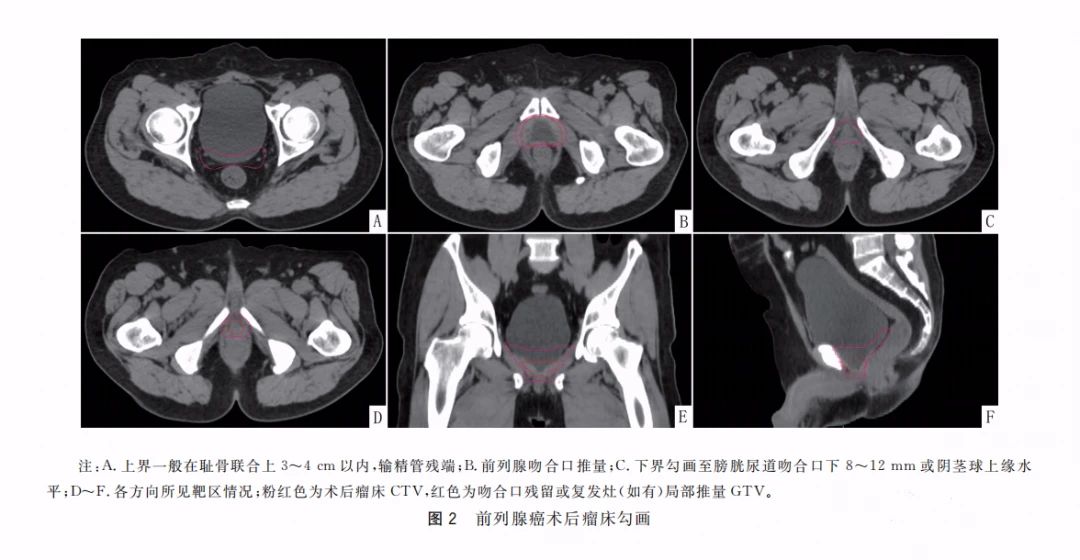
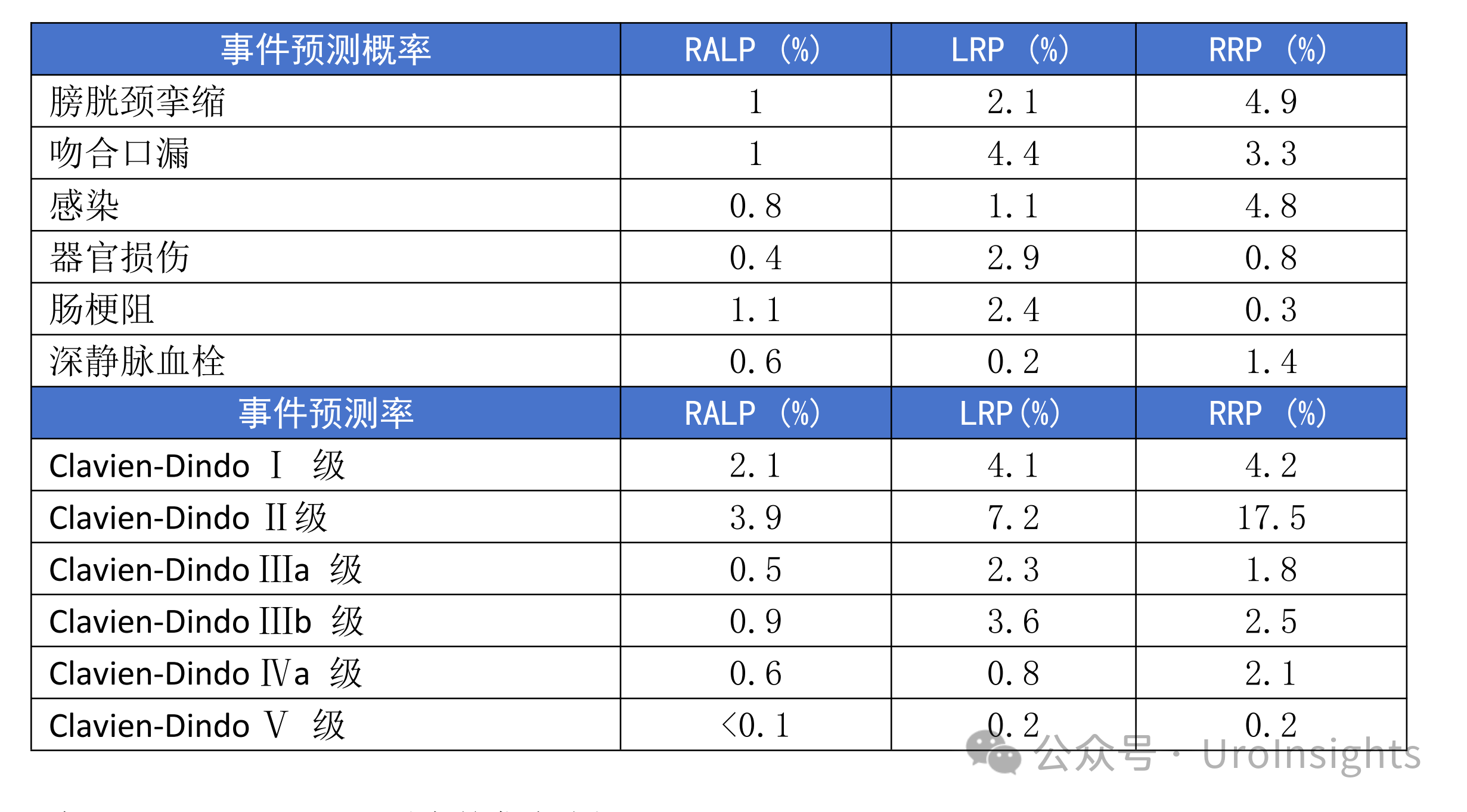
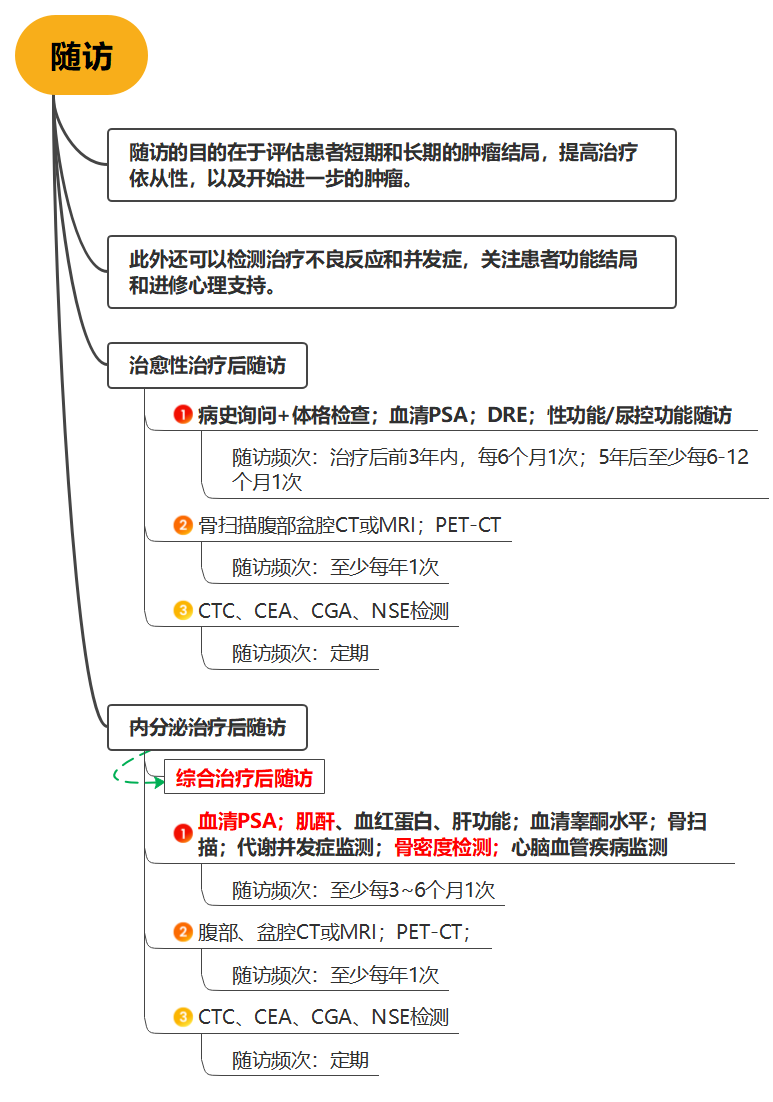
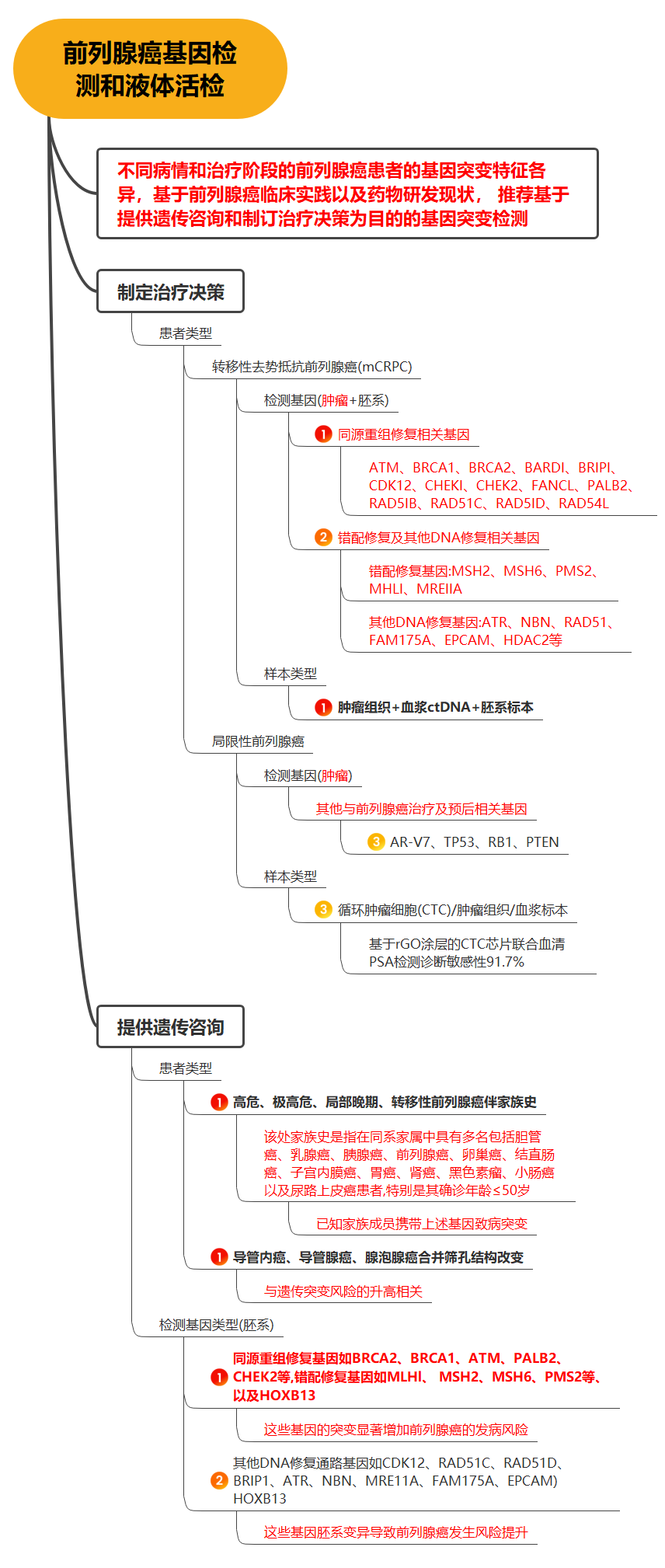
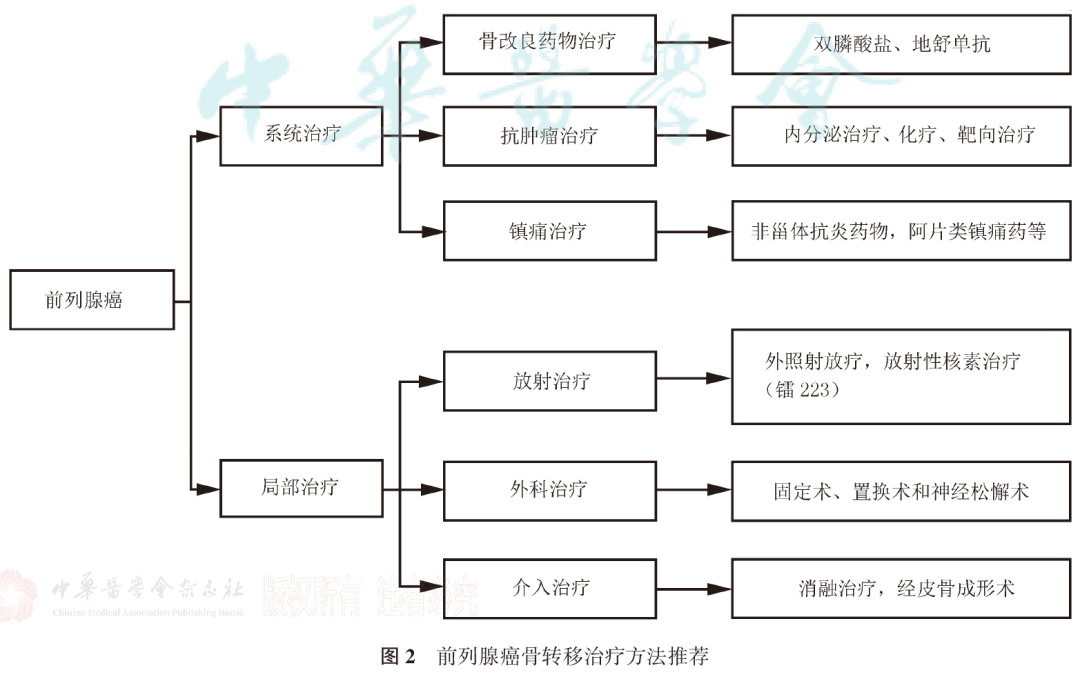
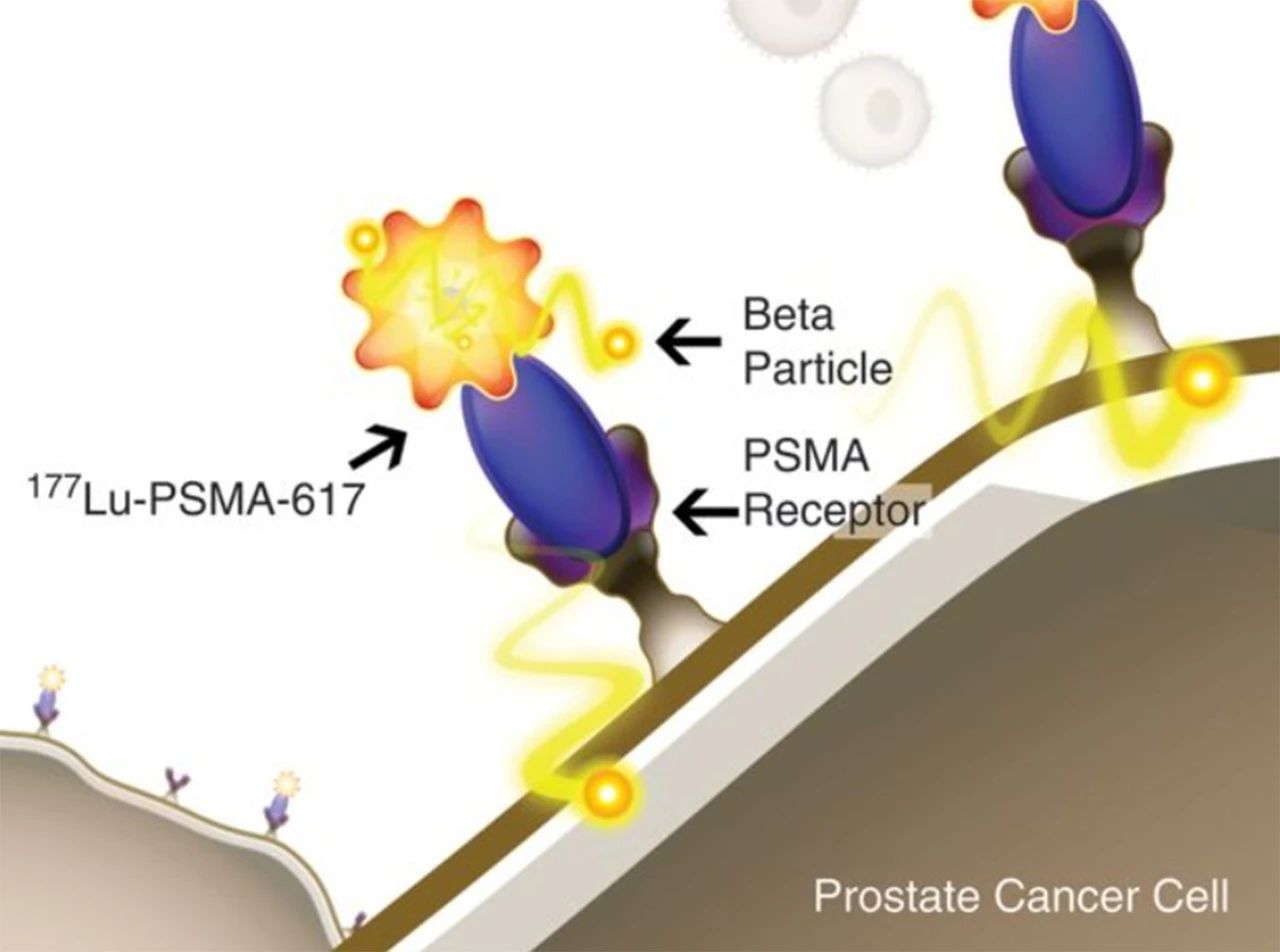
患者选择及治疗时机 专家共识推荐: 对于极低危和低危组,推荐即刻开始根治性放疗。 对于预后不良中危组,推荐新辅助内分泌治疗1~3个月后行根治性外放疗。 对于高危、极高危组以及区域淋巴结转移组,推荐新辅助内分泌治疗2~6个月后开始放疗。 根治性外放疗是前列腺癌治疗的重要组成部分,临床适应证为 T1-4N0-1M0期患者。对于预期寿命≥20年的极低危患者和预期寿命≥10年的低危患者、预后良好中危患者,可行单纯根治性外放疗。对于预后不良中危患者、高危、极高危以及区域淋巴结转移患者,推荐根治性外放疗联合内分泌治疗。 关于放疗开始时机,主要考虑是否行新辅助内分泌治疗及治疗时间。局部晚期患者的前列腺体积较大,推荐使用新辅助内分泌治疗缩小前列腺体积后再开始放疗,可达到减少照射体积、降低正常组织毒副作用的目的。而新辅助内分泌治疗的前3个月,前列腺体积缩小最为显著. 剂量方案 专家共识推荐: 采用3D-CRT 或IMRT 技术,常规分割放疗剂量≥78Gy、适度大分割和超大分割的患者,建议使用每日IGRT。 目前常用的IGRT 技术包 括: ① 锥 形 束 CT(CBCT); ② 兆 伏 级 CT(TO-MO); ③实时超声引导或其他图像引导(如实时正交X线透视等); ④置入金标+电子射野影像系统(EPID)拍摄验证片。 前列腺位置受直肠和膀胱体积影响较大,应当尽可能保持定位和每次治疗时膀胱和直肠状态的一致性。定位前2周对患者进行饮食管理,固定排便习惯,了解膀胱充盈度。模拟定位可根据需要,采用仰卧位或俯卧位进行体位固定。建议先行CT预扫描,确定直肠排空度符合要求后 (直 径 ≤3cm),继续补充饮水达到适当的膀胱充盈度(有条件的单位推荐使用 B 超检测膀胱容量),再行正式 CT平扫及增强扫描。扫描范围推荐自腰3椎体下缘至坐骨结节下3cm,层厚3mm。有条件单位根据 CT和 MRI融合定位图像指导靶区和正常器官勾画。 目前主要基于 CT 图像进行靶区勾画,MRI与定位 CT 融合可进一步提高靶区勾画准确性。 低危前列腺癌放疗靶区只包括前列腺,不包括精囊腺; 中危前列腺癌包括前列腺和1cm 精囊根部; 高危前列腺癌包含前列腺外0.5cm 组织及紧邻前列腺约2cm 的精囊腺范围;如果精囊受侵,则需要包括全部的精囊腺。 计划靶区(PTV)为 临 床 靶 区 ( CTV)向各方向外放5~10mm,但向后方向仅外放5~6mm 以减少直肠照射。对于有条件每天做IGRT的单位,PTV 外扩范围可缩小至3~5mm,可以进一步减少直肠反应发生几率。 对于有多个高危因素、根据 Roach公式或Partin表推断盆腔淋巴结转移几率>15%的前列腺癌,建议行盆腔淋巴引流区预防照射。盆腔淋巴引流区应包括髂外淋巴结、髂内淋巴结、骶1~3椎体水平骶前淋巴结和闭孔淋巴结;对于髂内外区域淋巴结转移的患者,可酌情包括部分髂总淋巴结正常组织和结构勾画包括直肠、膀胱、股骨头、小肠、结肠、肛管和阴茎球。 处方剂量可采用常规分割方案或低分割方案。 在常规分割模式下,低、中、高危/极高危患者推荐剂量分别为:75.6~79.2Gy、76~81Gy和≥81Gy。 适 度 大 分 割 方 案 包 括:70Gy/28f、60Gy/20f及70.2Gy/26f等。 对于极低危、低危和预后良好的中危患者,有条件的单位可以尝试超大分割方案:51.6Gy/12f、37Gy/5f、40Gy/5f和36.25Gy/5f等,但必须在精准的影像引导和严格的质控条件下实施。 对于不具备上述条件的单位,建议采用常规分割放疗。 对于需要进行盆腔淋巴结引流区照射的患者,预防剂量为45~50Gy;对于影像学证实的盆腔转移淋巴结,推荐剂量为50~70Gy,在保证正常组织安全前提下尽可能提高剂量。 放疗后 PSA 最低值基础上增加≥2ng/mL是放疗(或放疗联合内分泌治疗)后生化失败的标准定义。 放疗后 PSA 最低值(PSAnadir)是放疗后无生化复发生存的独立预后因素;而根治性放疗后 PSAnadir<0.5ng/mL提示预后良好。 术后放疗 患者选择 专家共识推荐: 有以下高危复发因素之一的患者推荐辅助放疗: 切缘阳性, pT3~4期, 盆腔淋巴结转移。 切缘阳性的患者是术后辅助放疗最主要的获益人群。对于术后生化复发(术后血清 PSA 检测连续2次≥0.2ng/mL)并无远处转移的患者,推荐即刻进行挽救放疗,可考虑同时给予6个月至1.5年的内分泌治疗。 在接受根治性前列腺切除术的患者中,具有pT3~4、淋巴结转移、切缘阳性等特征的患者表现了较高的生化复发、临床进展和肿瘤特异性死亡率。临床上推荐这部分患者接受辅助放疗。 根治性前列腺切除术后,患者的血清 PSA 在2~4周内下降到接近0值,并维持在一个非常低的水平,是术后肿瘤控制良好的表现。但据报道,前列腺癌根治术后有27%~53%的患者出现生化复发和/或临床复发。对于出现复发并排除远处转移的患者,建议即刻接受挽救放疗。 治疗时机 专家共识推荐: 通常在前列腺癌根治术后 1 年内、并且手术相关副作用改善或稳定时进行辅助放疗。 如果出现生化复发,排除远处转移,推荐尽早进行挽救放疗。 一些回顾性文献发现 PSA 水平升高但≤0.5ng/mL 时进行挽救性放疗,可以获得较好的长期疾病控制,被称为早期挽救性放疗。 推迟挽救放疗将可能降低疗效。 剂量方案 专家共 识 推 荐: 采 用 3D-CRT 或 IMRT 技 术。 对于有条件的单位,建议使用每日IGRT。 采用常规分割方案放疗;在保证正常组织安全前提下,瘤床推荐剂量为64~72Gy;若存在临床局部复发,放疗剂量需进一步提高。 对于需要进行盆腔淋巴结引流区照射的患者,预防剂量为45~50Gy; 对于影像学证实的复发盆腔淋巴结,推荐剂量为60~70Gy,在保证正常组织安全前提下尽可能提高剂量 前列腺癌术后瘤床 CTV 应包括吻合口、膀胱颈和直肠膀胱间隙。 具体勾画范围如下: 从输精管残端勾画至膀胱尿道吻合口下 8~12mm 或阴茎球上缘水平,上界除非有明确精囊腺受侵和肿瘤残存,一般上界限制在耻骨联合上3~4cm 以内;在耻骨联合以下水平前界在耻骨联合后方,后界达直肠前壁前,侧界延伸至肛提肌; 在耻骨联合以上前界包膀胱后1~2cm,后界达直肠系膜,侧界至邻近筋膜; 如果病理提示精囊腺受侵,应将精囊腺残端包全,如果无精囊腺受侵则不必包全精囊腺残端。 对于pN+和术后区域淋巴结复发的患者,推荐进行盆腔淋巴结引流区照射; 对于术中未行充分淋巴结清扫的高危患者,可考虑进行盆腔淋巴结引流区照射。照射区域包括髂外淋巴结、髂内淋巴结、闭孔淋巴结及S1~3 骶前淋巴结; 对于髂内外区域淋巴结转移的患者,可酌情包括部分髂总淋巴结。 术后放疗疗效评估,主要通过定期检测 PSA 等指标的变化及影像学相关检查进行评估。PSA<0.2ng/mL 是提示肿瘤控制良好的生化指标。 姑息性外放疗 患者选择 专家共识推荐: 对于原发灶引起尿频、尿急、尿痛、尿道梗阻、血尿和直肠压迫症状,以及转移灶引起脊髓压迫、压缩性骨折和疼痛的转移性前列腺癌,行原发灶和/或转移灶姑息放疗,可有效改善症状。 对于无 转 移 的 去 势 抵 抗 性 前 列 腺 癌 (CRPC),针对未接受过根治性治疗的原发灶进行放疗,可 能 延 缓 疾 病 进 展。 基于 HORRARD和STAMPEDE 等研究结果,对于寡转移前列腺癌,除了对转移灶进行姑息性放疗外,针对原发灶的放疗可延缓疾病发展、延长患者生存时间。 对于不伴有紧急状况的激素敏感型高瘤 负 荷 转 移 性 前 列 腺 癌 (mHSPC),建议先行系统治疗(包括内分泌治疗和化疗);在全身治疗有效的前提下,可考虑对主瘤荷部位和个别疗效欠佳的病灶行局部补充放疗。 对于伴有严重脊髓压迫、肿瘤引起的严重血尿等紧急状况的 HSPC,系统治疗未能快速有效地控制症状者,建议全身治疗同时尽快进行姑息减症放疗,必要时可联合手术减压、椎体局部固定以及介入栓塞止血等治疗。对于耐药的高瘤负荷转移性前列腺癌(mHRPC),建议更改系统治疗方案,在排除放疗禁忌证的前提下,仅针对引起明显症状的病灶选择性进行姑息减症放疗。 对于原发灶未经根治性治疗或原发灶经治疗后复发的 M0CRPC,建议换用二线内分泌治疗联合局部放疗。对于寡转移前列腺癌,推荐在内分泌治疗取得良好疗效的基础上,推荐对原发灶和/或转移灶进行减瘤性放疗。 原发灶的姑息放疗靶区勾画参考根治性放疗靶区,但原则上仅针对影像学可见病灶进行治疗,不推荐预防性照射。转移灶的靶区认定,需要综合 MRI、CT、骨扫描等影像资料;对于寡转移病灶的认定,推荐参考前列腺特异性膜抗原(PSMA)PET/CT。 原发灶姑息放疗的剂量推荐,可参考根治性放疗;对于局部肿瘤巨大、患者一般情况较差的患者,可酌情降低剂量。 在患者可耐受的前提下,以减瘤为目的的原发灶放疗,剂量建议不低于70Gy/35f;以减症为目的的原发灶放疗,剂量建议不低于50~60Gy/25~30f。 转移灶的姑息放疗,根据治疗范围及治疗单位条件,可选择 SBRT 或者常规分割方案放疗。在具备相应技术条件的治疗单位,推荐 SBRT 用于治疗范围较小的转移灶。采用的方案包括:50Gy/10f、30Gy/5f、24~30Gy/3f、16~20Gy/1f等,可以达到较常规分割方案起效更快、局部控制更持久的效果。 对于不适合 SBRT 或不具备实施条件的情况,建议采用常规分割放疗。常用方案包括:30Gy/10f、40Gy/20f、20Gy/5f、37.5Gy/15f等,也可以获得较好的止痛、减瘤效果。 治疗时机 专家共识推荐: 对于初诊符合近距离放疗适应证的患者,可以考虑即刻行永久性 LDR 植入或暂时性HDR 插植。 对于初诊前列腺体积大、高IPSS 评分的患者,采用新辅助内分泌治疗缩小前列腺至适合的体积,再行近距离放疗,可降低治疗相关毒性;内分泌治疗前需要评估治疗获益和潜在风险。 对于经病理确认的外放疗或近距离放疗后复发的患者,需要依照NCCN 指南重新分期,除外区域和远处转移,可以考虑永久性 LDR植入和暂时性 HDR 插植。 与初次近距离治疗相比,挽救性近距离治疗相关的泌尿系症状、肠道毒性和性功能障碍均会加重。 近距离放射治疗包括两种方法:低剂量 率 (LDR)和 高 剂 量 率 (HDR)。LDR近距离放疗是将放射性粒子永久性植入前列腺内实施放疗,HDR 近距离放疗是将放射源短暂插植到前列腺内实施放疗。LDR 近距离放疗10年无复发生存率可以达到85%。HDR 近距离放疗通常与外放疗联合,用于中高危前列腺癌外放疗之后局部加量。 实施前列腺癌近距离放疗,在患者选择上需满足以下条件: ①极低危/低危/选择性中高危患者(Gleason评分3+4); ② 前列腺体积20~60mL; ③无前列腺电切手术史; ④国际前列腺症状 评 分 ( IPSS)小于12分;⑤无急性前列腺炎症。 技术流程 专家共识推荐:近距离放疗技术流程包括模拟定位、术前计划、粒子植入和术后验证4个环节。必须在有近距离放疗三维计划系统和严格的质控体系的治疗单位,由有经验的近距离放射治疗医师实施。 模拟定位:TRUS是评估前列腺体积,确定轴位和矢状位方向前列腺基底部和尖部的有效方法,也是高质量 LDR粒子植入的基础,推荐在近距离治疗前一天或手术前即刻进行。 术前计划:经直肠前列腺超声图像是标准治疗计划用图像,CT 或 MRI图像亦可用于治疗计划设计,MRI与超声影像结合技术有助于更好地识别病灶。术前计划获得根据模板设计的最佳布针位置、最少的粒子数量、最高的靶区覆盖和最低的高剂量区体积,计划必须同时满足处方剂量要求和危及器官(尿道和直肠)剂量限制。 粒子植入:在超声引导下根据术前计划设计的穿刺路径经会阴部穿刺,放置穿刺针,根据术中图像进行术中计划修正。穿刺针到位后,使用 Mick枪将粒子按照计划设计的位置植入前列腺内。 术后验证:推荐术后30d行以 CT 影像为基础的术后剂量验证,如果条件允许,CT 与 MR 影像结合有助于提高术后计划评估效力。术后验证需要计算靶区及危及器官获得的剂量体积直方图;如果靶区没有获得足够的剂量,需要考虑行二次粒子植入。 125I粒子、103Pd粒子和131Cs粒子植入作为单一治疗,推荐的处方剂量分别为 140~160Gy、110~125Gy和115Gy。 当 LDR与外放疗联合,推 荐 前 列 腺 及 其 周 围 外 放 疗 剂 量 为 45~50.4Gy,粒子植入的处方剂量为:125I粒子100~110Gy、103Pd粒子80~110Gy、131Cs粒子85Gy。 HDR单一治疗的推荐剂量为27Gy/13.5Gy/2f/2d、38Gy/9.5Gy/4f/2d。HDR 与外放疗联合治疗,HDR 推荐剂量为21.5Gy/10.5Gy/2f/2d、12~15Gy/1f/1d。 质子重离子放射治疗由于其优越的物理剂量分布,理论上可以更好地保护肿瘤周围正常组织;目前有条件开展质子既/或重离子治疗的单位可考虑前列腺癌的质子/或重离子辅助放疗或挽救性放疗。 其患者选择及时机可参考光子放疗。临床应用中,应结合功能性成像技术,提高肿瘤靶区确定精度;由于质子重离子治疗时其剂量分布的高剂量区和低剂量区界限比光子更明确,因此对靶区勾画、放疗计划设计、体位固定、质量控制和质量保证等要求均需更为严格,在治疗时应用图像引导技术提高治疗时的摆位精度。 临床风险事件的管理和控制 前列腺癌放疗早期副反应是指从放疗开始到放疗结束后3个月内发生的不良反应,主要包括泌尿生殖系统(GU)毒性反应和胃肠道( GI)毒性反应,其次还包括骨髓抑制。建议采用常见不良反应术语标准(CTCAE)4.0版 进行分级处理。 GU 早期副反应主要是膀胱炎/尿道炎,主要表现为排尿困难、尿频、尿急、尿失禁、血尿、尿等待、尿潴留及尿流变细等。这些症状通常是轻到中度,且通常在放疗结束后2~4周缓解。GU 早期副反应的发生率与放疗前的尿路症状有关,即放疗前存在下尿路症状的患者出现 GU 早期副反应的比例高于治疗开始时没有症状的患者。 常规分割外照 射 GU1、2、3 级 早 期 副 反 应 发 生 率 分 别 是28.7%~51.9%、15.6%~41.4%、1.1%~8.1%;中等分割-大分割外照射 GU1、2、3级早期副反应发生率分别是13.3%~71%、12%~25%、0%~3%;4度反应罕见。 大多数研究的结果表明低分割放疗引起的 GU 早期副反应与常规分割放疗没有统计学差异。对于<3级的副反应予以观察或对症治疗;若出现3级早期副反应则需暂停放疗,予以积极对症支持治疗,待症状好转稳定后,可继续放疗;若出现4级或更严重副反应,则需终止放疗。 GI早期副反应主要表现为急性肠炎。其发生的严重程度与小肠和大肠的受照体积有关。放疗结束后,这些症状大多可在2~4周内恢复到基线状态。直肠急性毒性反应的发生率与直肠晚期副反应相关。RTOG 剂量爬坡试验证实发生2级及以上急性直肠副反应的患者,其3级及以上直肠晚期副反应的发生率明显升高。 在放疗技术方面,与3D-CRT 技术相比,IMRT 显著降低了 GI副反应发生率。对于早期前列腺癌常规分割外照射的 GI1、2、3级早期 副 反 应 的 发 生 率 分 别 是 16.1% ~51.1%、6.3%~20.7%、0%~3%;适度大分割-超大分割外照射的 GI1、2、3级早期副反应发生率分别是13%~67%、1% ~27%、0% ~9%。 局部晚期 前 列腺癌常规分割外照射的≥2级早期 GI副反应发生率为9.1%,适度大分割-超大分割外照射的≥2级早期GI副反应发生率为13.4%。1级 GI副反应可密切观察;2级 GI副反应建议予抗副交感神经药物或镇痛治疗,适当口服补液;3级副反应建议暂停放疗,积极对症治疗,静脉补液,待症状好转稳定后再行放疗。若出现4级或更严重副反应,则需终止放疗。 在前列腺癌放疗中发生骨髓抑制几率较低,但仍建议在放疗前和放疗期间监测患者血常规。骨髓抑制可表现为白细胞减少、中性粒细胞下降、贫血和/或血小板下降。放疗期间,骨髓抑制建议对症支持处理;若出现3度及以上骨髓抑制,建议暂停放疗并积极对症支持处理,待骨髓功能恢复正常再继续放疗。 前列腺癌放疗晚期副反应是指放疗结束后3个月之后发生的不良反应,主要包括 GI晚期反应、GU 晚期反应和勃起功 能 障 碍 (ED)。建 议 采 用RTOG/EORTC进行分级处理。 GI晚期副反应主要表现为:腹泻、肠痉挛、肠溃疡和出血等。在目前精准放疗技术时代,GI晚期副反应发生率已较传统放疗显著降低。常规分割放疗后3个月 GI副反应发生率约为22%,12个月以上约为16%;其中,3级及以上副反应少见(<3%)。 与常规分割放疗相比,适度大分割-超大分割放疗(包括 SBRT)、质子治疗未增加晚期GI副反应发生几率。高龄、较大的直肠照射体积、药物去势与化疗的同期应用、腹部外科手术史、糖尿病史和炎症性肠病史等因素是 GI晚期副反应发生的风险因素。治疗上以对症处理为主(解痉、止泻、止血、必要时输血);出现3级以上需要外科处理的严重副反应罕见。 通过相关风险因素,评估患者出现 GI晚期副反应的风险水平,制定更精准的放射治疗计划、控制好各种合并症可能会有助于减少肠道副反应的发生几率 。 GU 晚期副反应主要表现为:尿频、夜尿增多、血尿和尿路狭窄等;发生率约为32%~42%,3度及以上严重副反应少见(约1%)。 大多数经保守治疗后逐渐缓解,严重者需积极干预。一般在放疗结束后1~2年内逐步恢复正常。治疗上以解痉、止血、抗炎、膀胱冲洗等对症处理为主;若出现尿道梗阻、膀胱挛缩、瘘道形成,需要手术治疗。 前列腺癌患者放疗后 ED 发生率约为28%。按照国际勃起功能指数(IIEF-5)进行评级,12~21分为轻度 ED,8~11分为中度 ED,5~7分为重度 ED。 部分患者在诊断前列腺癌前就有 ED 症状,因此,放疗前的勃起功能评价是需要的。患者年龄、基础性功能、肥胖、去势治疗都是影响患者勃起功能的因素。部分研究发现对性器 官 (阴 茎 球、阴 部 动脉、阴茎海绵体)的剂量优化可能可以减少 ED 的发生。 放疗后发生勃起功能障碍应排查放疗外的其他原因;治 疗 上 可 以 选 择 心 理 疏 导 或 药 物 治 疗 (如PDE5抑制剂等);动脉血管重建等外科手段也可作为治疗选择。 放射诱发癌,是指发生在照射野内,与既往放疗有关,但与原发肿瘤病理类型不同的第二原发肿瘤,一般发生在放疗后7~12年,是第二原发癌的一部分。目前尚缺乏前列腺癌放疗后放射诱发癌的直接数据,但大多数研究认为:前列腺癌放疗一定程度上增加了第二原发癌的发生几率。 前列腺癌放疗后第二原发癌主要发生在结直肠和膀胱,发生率为0.1%~4.2%,但总体上并不影响患者的总体生存。